Biohaven Ltd. (BHVN) (Biohaven หรือบริษัท) ประกาศผลการดําเนินงานในเชิงบวกจากการศึกษาที่สําคัญ BHV4157-206-RWE (NCT06529146) ที่แสดงให้เห็นถึงประสิทธิภาพของ troriluzole ต่อการเปลี่ยนแปลงเฉลี่ยจากพื้นฐานใน f-SARA หลังจากการรักษา 3 ปี การศึกษาบรรลุจุดสิ้นสุดหลักและแสดงให้เห็นถึงการปรับปรุงอย่างมีนัยสําคัญทางสถิติของ f-SARA ในปีที่ 1 และ 2 (รูปที่ 1) SCA เป็นโรคทางระบบประสาทที่หายากและทําให้ร่างกายอ่อนแออย่างต่อเนื่อง ซึ่งส่งผลกระทบต่อผู้คนประมาณ 15,000 คน
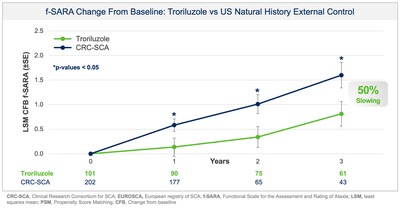
โดยรวมแล้ว ข้อมูลจากการวิเคราะห์หลายรายการแสดงให้เห็นถึงการชะลอการลุกลามของโรคในผู้ป่วย SCA ที่แข็งแกร่งและมีความหมายทางคลินิก ประโยชน์ในการรักษาเหล่านี้แปลเป็นอัตราการลดลงที่ช้าลง 50-70% เมื่อเทียบกับผู้ป่วยที่ไม่ได้รับการรักษา ซึ่งแสดงถึงความล่าช้า 1.5-2.2 ปีในการลุกลามของโรคในช่วงระยะเวลาการศึกษา 3 ปี นอกจากนี้ ในการวิเคราะห์ความไวของผู้ตอบสนอง การลุกลามของโรคเมื่อกําหนดโดยอาการแย่ลง 2 จุดขึ้นไปใน f-SARA ที่ 3 ปีแสดงอัตราส่วนอัตราต่อรอง (OR) ที่ 4.1 (95% CI: 2.1, 8.1) สําหรับกลุ่มควบคุมภายนอกที่ไม่ได้รับการรักษาเทียบกับผู้ที่ได้รับการรักษาด้วย troriluzole (p < 0.0001; pooled analysis).
ดร.
การศึกษา BHV4157-206-RWE ได้รับการออกแบบโดยการหารือกับสํานักงาน คณะกรรมการอาหารและยาแห่งสหรัฐอเมริกา (FDA) เพื่อประเมินประสิทธิผลของ troriluzole ใน SCA หลังจากการรักษา 3 ปี โดยวัดจากการเปลี่ยนแปลงจากพื้นฐานใน f-SARA การศึกษานี้ใช้ข้อมูลระยะที่ 3 และการควบคุมภายนอกของอาสาสมัคร SCA ที่ตรงกันและไม่ได้รับการรักษาจาก US Clinical Research Consortium for the Study of Cerebellar Ataxia (CRC-SCA) ตามคําแนะนํา ของ FDA เกี่ยวกับหลักฐานในโลกแห่งความเป็นจริง (RWE) ของประสิทธิผล จุดสิ้นสุดทั้งหมดถูกระบุไว้ล่วงหน้า และทั้งโปรโตคอลการศึกษาและแผนการวิเคราะห์ทางสถิติถูกส่งไปยังและตรวจสอบโดย FDA ก่อนการวิเคราะห์ข้อมูลบรรทัดบน การวิเคราะห์ใหม่เพิ่มเป็นสองเท่าของข้อมูล 3 ปีที่มีอยู่ก่อนหน้านี้ โดยขณะนี้อาสาสมัคร 63 คนเสร็จสิ้นการรักษา 3 ปีด้วย troriluzole และจับคู่กับแขนควบคุมภายนอก การจับคู่คะแนนแนวโน้ม (PSM) ถูกนํามาใช้เพื่อให้แน่ใจว่าผู้ป่วยที่ไม่ได้รับการรักษาจากการศึกษา CRC-SCA ได้รับการจับคู่อย่างเข้มงวดกับผู้ป่วยที่ได้รับการรักษาจากการศึกษา BHV4157-206 ในลักษณะพื้นฐาน วัตถุประสงค์หลักคือเพื่อตรวจสอบผลการรักษาของ troriluzole นานถึง 3 ปี โดยการเปรียบเทียบข้อมูลเกี่ยวกับ f-SARA จากผู้ป่วยที่ได้รับการรักษาด้วย troriluzole ในการศึกษา BHV4157-206 กับผู้ป่วยที่ไม่ได้รับการรักษาจากการศึกษาประวัติธรรมชาติ ผู้ป่วยที่ได้รับการรักษาด้วย Troriluzole แสดงให้เห็นถึงประโยชน์ที่มีนัยสําคัญทางสถิติและยั่งยืนในปีที่ 1, 2 และ 3 ใน f-SARA เมื่อเทียบกับการควบคุมประวัติธรรมชาติที่ตรงกันอย่างเคร่งครัด
นอกจากนี้ การวิเคราะห์ที่ระบุไว้ล่วงหน้าในโปรโตคอลยังใช้การควบคุมประวัติศาสตร์ธรรมชาติที่แยกจากการศึกษาประวัติศาสตร์ธรรมชาติ SCA ของยุโรป (EUROSCA) เพื่อวัตถุประสงค์ในการกํากับดูแลระดับโลก ผลลัพธ์โดยใช้ผู้ป่วย EUROSCA นอกเหนือจากการวิเคราะห์แบบรวมโดยใช้ทั้งผู้ป่วย CRC-SCA และ EUROSCA เนื่องจากการควบคุมภายนอกยังมีนัยสําคัญทางสถิติและสอดคล้องกับการวิเคราะห์ประสิทธิภาพเบื้องต้นในทุกช่วงเวลา (ดูรูปที่ 2 และรูปที่ 3) การเพิ่มข้อมูล EUROSCA เพิ่มขนาดตัวอย่างควบคุมภายนอกและเพิ่มความแข็งแกร่งของความแตกต่างในการรักษาที่มีนัยสําคัญทางสถิติในปีที่ 1, 2 และ 3 ซึ่งสนับสนุน troriluzole
ความผิดปกติของโรคกระดูกสันหลังเป็นกลุ่มของความผิดปกติของระบบประสาทที่ถ่ายทอดทางพันธุกรรมที่โดดเด่นโดยสูญเสียการควบคุมการเคลื่อนไหวโดยสมัครใจและการฝ่อของสมองน้อยก้านสมองและไขสันหลัง ผู้ป่วยประสบกับการเจ็บป่วยอย่างมีนัยสําคัญ รวมถึงการลุกลามไปสู่เก้าอี้รถเข็น การเดินบกพร่องที่นําไปสู่การหกล้ม ไม่สามารถสื่อสารได้เนื่องจากความบกพร่องทางการพูด กลืนลําบาก และการเสียชีวิตก่อนวัยอันควร แม้ว่าสัญญาณและอาการจะปรากฏได้ทุกเมื่อตั้งแต่วัยเด็กจนถึงวัยผู้ใหญ่ตอนปลาย แต่โดยทั่วไปแล้ว SCA จะปรากฏในวัยผู้ใหญ่ตอนต้นและดําเนินไปในช่วงหลายปี ปัจจุบันยังไม่มีการรักษาที่ได้รับการอนุมัติจาก FDA และไม่มีการรักษา SCA
จากข้อมูลท็อปไลน์จากการศึกษา BHV4157-206-RWE และข้อมูลความปลอดภัยและประสิทธิภาพก่อนหน้านี้จากโครงการพัฒนา troriluzole ใน SCA Biohaven วางแผนที่จะยื่นใบสมัครยาใหม่ (NDA) ไปยัง FDA ในไตรมาสที่ 4 ปี 2024 โครงการพัฒนา troriluzole ได้สร้างชุดข้อมูลการทดลองทางคลินิกที่ใหญ่ที่สุดใน SCA และขณะนี้มีการติดตามผลในผู้ป่วยบางรายที่ได้รับการรักษาด้วย troriluzole มานานกว่า 5 ปี ก่อนหน้านี้ Biohaven ได้รับการกําหนดทั้ง Fast-Track และ Orphan Drug Designation (ODD) จาก FDA และ ODD จาก European Medicines Agency สําหรับ troriluzole ใน SCA NDA ที่มี ODD มีสิทธิ์ได้รับการตรวจสอบของ FDA ตามลําดับความสําคัญ Biohaven จะเตรียมพร้อมที่จะทําการค้า SCA ในสหรัฐอเมริกาในปี 2025 หากได้รับการอนุมัติในที่สุด โดยพิจารณาจากไทม์ไลน์การตรวจสอบลําดับความสําคัญที่อาจเกิดขึ้น
รายละเอียดการประชุมทางโทรศัพท์และเว็บคาสต์
Biohaven จะจัดการประชุมทางโทรศัพท์สดและเว็บคาสต์ในวันนี้เวลา 8:30 น. ตามเวลาตะวันออก เว็บคาสต์สามารถเข้าถึงได้ผ่านส่วนนักลงทุนสัมพันธ์ของเว็บไซต์ ของ Biohaven ที่ https://ir.biohaven.com/events-presentations/events หากต้องการเข้าร่วมการประชุมทางโทรศัพท์แบบสด โปรดลงทะเบียน ที่นี่ เมื่อลงทะเบียน จะมีหมายเลขโทรเข้าและ PIN เฉพาะเพื่อเข้าร่วมการประชุมทางโทรศัพท์
บทความนี้ถูกแปลโดยใช้ความช่วยเหลือจากปัญญาประดิษฐ์(AI) สำหรับข้อมูลเพิ่มเติม โปรดอ่านข้อกำหนดการใช้งาน
